Pubblicato in Gazzetta Ufficiale il decreto legislativo 2 febbraio 2021, n. 27 relativo alle disposizioni per l’adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2017/625 ai sensi dell’articolo 12, lettere a), b), c), d) ed e) della legge 4 ottobre 2019, n. 117. (21G00034)
(GU n.60 del 11-3-2021)
Vigente al: 26-3-2021
Qui di seguito AGRICOLAE pubblica il testo integrale:
IL PRESIDENTE DELLA REPUBBLICA
Visti gli articoli 76 e 87 della Costituzione;
Vista la legge 23 agosto 1988, n. 400, recante disciplina dell’attivita’ di Governo e ordinamento della Presidenza del Consiglio dei ministri e, in particolare, l’articolo 14;
Vista la legge 24 dicembre 2012, n. 234, recante norme generali sulla partecipazione dell’Italia alla formazione e all’attuazione della normativa e delle politiche dell’Unione europea e, in particolare, l’articolo 31;
Vista la legge 4 ottobre 2019, n. 117, recante delega al Governo per il recepimento delle direttive europee e l’attuazione di altri atti dell’Unione europea – Legge di delegazione europea 2018 e, in particolare, l’articolo 12, lettere a), b), c), d) ed e);
Visto il regolamento (CEE) n. 315/1993 del Consiglio, dell’8 febbraio 1993, che stabilisce procedure comunitarie relative ai contaminanti nei prodotti alimentari;
Visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati;
Visto il regolamento (CE) 1831/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, sugli additivi destinati all’alimentazione animale;
Visto il regolamento (CE) n. 852/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, sull’igiene dei prodotti alimentari;
Visto il regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, che stabilisce norme specifiche in materia di igiene per gli alimenti di origine animale;
Visto il regolamento (CE) n. 183/2005 del Parlamento europeo e del Consiglio, del 12 gennaio 2005, che stabilisce requisiti per l’igiene dei mangimi;
Visto il regolamento (CE) n. 401/2006 della Commissione, del 23 febbraio 2006, relativo ai metodi di campionamento e di analisi per il controllo ufficiale dei tenori di micotossine nei prodotti alimentari;
Visto il regolamento (CE) n. 1881/2006 della Commissione, del 19 dicembre 2006, che definisce i tenori massimi di alcuni contaminanti nei prodotti alimentari;
Visto il regolamento (CE) n. 1882/2006 della Commissione, del 19 dicembre 2006, che stabilisce metodi di campionamento ed analisi per il controllo ufficiale del tenore di nitrati in alcuni prodotti alimentari;
Visto il regolamento (CE) n. 1924/2006 del Parlamento europeo e del Consiglio, del 20 dicembre 2006, relativo alle indicazioni nutrizionali e sulla salute fornite sui prodotti alimentari;
Visto il regolamento (CE) 1925/2006 del Parlamento europeo e del Consiglio, del 20 dicembre 2006 sull’aggiunta di vitamine e minerali e di talune altre sostanze agli alimenti;
Visto il regolamento (CE) n. 333/2007 della Commissione, del 28 marzo 2007, relativo ai metodi di campionamento e di analisi per il controllo ufficiale dei tenori di piombo, cadmio, mercurio, stagno inorganico, 3-MCPD e benzo(a)pirene nei prodotti alimentari;
Visto il regolamento (CE) n. 767/2009 del Parlamento europeo e del Consiglio, del 13 luglio 2009, sull’immissione sul mercato e sull’uso dei mangimi, che modifica il regolamento (CE) n. 1831/2003 e che abroga le direttive 79/373/CEE del Consiglio, 80/511/CEE della
Commissione, 82/471/CEE del Consiglio, 83/228/CEE del Consiglio, 93/74/CEE del Consiglio, 93/113/CE del Consiglio e 96/25/CE del Consiglio e la decisione 2004/217/CE della Commissione;
Visto il regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio, del 21 ottobre 2009, recante norme sanitarie relative ai sottoprodotti di origine animale e ai prodotti derivati non destinati al consumo umano e che abroga il regolamento (CE) n. 1774/2002 (regolamento sui sottoprodotti di origine animale);
Visto il regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio, del 21 ottobre 2009, relativo all’immissione sul mercato dei prodotti fitosanitari e che abroga le direttive del Consiglio 79/117/CEE e 91/414/CEE;
Visto il regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio, del 12 giugno 2013, relativo agli alimenti destinati ai lattanti e ai bambini nella prima infanzia, agli alimenti a fini medici speciali e ai sostituti dell’intera razione alimentare giornaliera per il controllo del peso e che abroga la direttiva 92/52/CEE del Consiglio, le direttive 96/8/CE, 1999/21/CE, 2006/125/CE e 2006/141/CE della Commissione, la direttiva 2009/39/CE del Parlamento europeo e del Consiglio e i regolamenti (CE) n. 41/2009 e (CE) n. 953/2009 della Commissione;
Visto il regolamento (UE) 2015/705 della Commissione, del 30 aprile 2015, che stabilisce i metodi di campionamento e i criteri di rendimento per i metodi di analisi per il controllo ufficiale dei tenori di acido erucico negli alimenti e che abroga la direttiva 80/891/CEE della Commissione;
Visto il regolamento delegato (UE) 2016/127 della Commissione, del 25 settembre 2015, che integra il regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio per quanto riguarda le prescrizioni specifiche di composizione e di informazione per le formule per lattanti e le formule di proseguimento e per quanto riguarda le prescrizioni relative alle informazioni sull’alimentazione del lattante e del bambino nella prima infanzia;
Visto il regolamento delegato (UE) 2016/128 della Commissione, del 25 settembre 2015, che integra il regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio per quanto riguarda le prescrizioni specifiche in materia di composizione e di informazione per gli alimenti destinati a fini medici speciali;
Visto il regolamento (UE) 2016/429 del Parlamento europeo e del Consiglio, del 9 marzo 2016, relativo alle malattie animali trasmissibili e che modifica e abroga taluni atti in materia di sanita’ animale;
Visto il regolamento (UE) 2017/625 del Parlamento europeo e del Consiglio, del 15 marzo 2017, relativo ai controlli ufficiali e alle altre attivita’ ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi, delle norme sulla salute e sul benessere degli animali, sulla sanita’ delle piante nonche’ sui prodotti fitosanitari, recante modifica dei regolamenti (CE) n. 999/ 2001, (CE) n. 396/2005, (CE) n. 1069/2009, (CE) n. 1107/2009, (UE) n. 1151/2012, (UE) n. 652/2014, (UE) 2016/429 e (UE) 2016/2031 del Parlamento europeo e del Consiglio, dei regolamenti (CE) n. 1/2005 e (CE) n. 1099/2009 del Consiglio e delle direttive 98/58/CE, 1999/74/CE, 2007/43/CE, 2008/119/ CE e 2008/120/CE del Consiglio, e che abroga i regolamenti (CE) n. 854/2004 e (CE) n. 882/2004 del Parlamento europeo e del Consiglio, le direttive 89/608/CEE, 89/662/CEE, 90/425/CEE, 91/496/CEE, 96/23/CE, 96/93/CE e 97/78/CE del Consiglio e la decisione 92/438/CEE del Consiglio
(regolamento sui controlli ufficiali);
Visto il regolamento (UE) 2017/644 della Commissione, del 5 aprile 2017, che stabilisce i metodi di campionamento e di analisi per il controllo dei livelli di diossine, PCB diossina-simili e PCB non diossina-simili in alcuni prodotti alimentari e che abroga il regolamento (UE) n. 589/2014;
Visto il regolamento delegato 2019/2090 della Commissione, del 19 giugno 2019, che integra il regolamento (UE) 2017/625 del Parlamento europeo e del Consiglio per quanto riguarda i casi di sospetta o accertata non conformita’ alle norme dell’Unione applicabili all’uso o ai residui di sostanze farmacologicamente attive autorizzate nei medicinali veterinari o come additivi per mangimi o alle norme dell’Unione applicabili all’uso o ai residui di sostanze farmacologicamente attive vietate o non autorizzate;
Vista la direttiva 2002/46/CE del Parlamento europeo e del Consiglio, del 10 giugno 2002, per il ravvicinamento delle legislazioni degli stati membri relative agli integratori alimentari;
Vista la direttiva 2006/125/CE della Commissione, del 5 dicembre 2006, sugli alimenti a base di cereali e gli altri alimenti destinati ai lattanti e ai bambini;
Vista la legge 30 aprile 1962, n. 283, recante modifica degli articoli 242, 243, 247, 250 e 262 del testo unico delle leggi sanitarie approvato con regio decreto 27 luglio 1934, n. 1265, recante disciplina igienica della produzione e della vendita delle sostanze alimentari e delle bevande;
Vista la legge 24 novembre 1981, n. 689, recante modifiche al sistema penale;
Visto il regio decreto 9 maggio 1929, n. 994, recante approvazione del regolamento sulla vigilanza igienica del latte destinato al consumo diretto.
Visto il regio decreto 20 dicembre 1928, n. 3298, recante approvazione del regolamento per la vigilanza sanitaria delle carni;
Visto il decreto-legge 18 luglio 1986, n. 282, convertito, con modificazioni, dalla legge 7 agosto 1986, n. 462, recante misure urgenti in materia di prevenzione e repressione delle sofisticazioni alimentari;
Visto il decreto del Presidente della Repubblica 14 luglio 1995, recante atto di indirizzo e coordinamento alle regioni e province autonome sui criteri uniformi per l’elaborazione dei programmi di controllo ufficiale degli alimenti e bevande, pubblicato nella Gazzetta Ufficiale n. 260, S.O., del 7 novembre 1995.;
Visto il decreto legislativo 27 gennaio 1992, n. 110, recante attuazione della direttiva 89/108/CEE in materia di alimenti surgelati destinati all’alimentazione umana, limitatamente all’articolo 10 sulla importazione alimenti surgelati provenienti da Paesi non appartenenti alla CEE;
Visto il decreto legislativo 27 gennaio 1992, n. 111, recante attuazione della direttiva 89/398/CEE concernente i prodotti alimentari destinati ad una alimentazione particolare;
Visto il decreto legislativo 3 marzo 1993, n. 123, recante attuazione della direttiva 89/397/CEE relativa al controllo ufficiale dei prodotti alimentari;
Visto il decreto legislativo 24 febbraio 1997, n. 45, recante attuazione delle direttive 93/74/CEE, 94/39/CE, 95/9/CE e 95/10/CE in materia di alimenti dietetici per animali;
Visto il decreto del Presidente della Repubblica 10 febbraio 1998, n. 214, concernente regolamento recante norme di attuazione della direttiva 93/113/CE relativa alla utilizzazione ed alla
commercializzazione degli enzimi, dei microrganismi e di loro preparati nell’alimentazione degli animali;
Visto il decreto legislativo 26 maggio 1997, n. 156, recante attuazione della direttiva 93/99/CEE concernente misure supplementari in merito al controllo ufficiale dei prodotti alimentari;
Visto il decreto legislativo del 13 aprile 1999, n. 123, recante attuazione della direttiva 95/69/CE che fissa le condizioni e le modalita’ per il riconoscimento e la registrazione di taluni stabilimenti ed intermediari operanti nel settore dell’alimentazione degli animali;
Visto il decreto legislativo 30 dicembre 1999, n. 507, recante depenalizzazione dei reati minori e riforma del sistema sanzionatorio, ai sensi dell’articolo 1 della legge 25 giugno 1999, n. 205;
Visto il decreto del Presidente della Repubblica 23 aprile 2001, n. 290, recante regolamento di semplificazione dei procedimenti di autorizzazione alla produzione, alla immissione in commercio e alla vendita di prodotti fitosanitari e relativi coadiuvanti;
Visto il decreto legislativo 21 maggio 2004, n. 169, recante attuazione della direttiva 2002/46/CE relativa agli integratori alimentari;
Visto il decreto legislativo 9 aprile 2003, n. 70, recante attuazione della direttiva 2000/31/CE relativa a taluni aspetti giuridici dei servizi della societa’ dell’informazione nel mercato interno, con particolare riferimento al commercio elettronico;
Visto il decreto legislativo 6 aprile 2006, n. 193, recante attuazione della direttiva 2004/28/CE recante codice comunitario dei medicinali veterinari;
Visto il decreto legislativo 16 marzo 2006, n. 158, recante attuazione della direttiva 2003/74/CE, che modifica la direttiva 96/22/CE del Consiglio, del 29 aprile 1996, concernente il divieto di utilizzazione di talune sostanze ad azione ormonica, tireostatica e delle sostanze beta-agoniste nelle produzioni animali e della direttiva 96/23/CE, del Consiglio, del 29 aprile 1996, concernente le misure di controllo su talune sostanze e sui loro residui negli animali vivi e nei loro prodotti, come modificata dal regolamento 882/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, nonche’ abrogazione del decreto legislativo 4 agosto 1999, n. 336;
Visto il decreto legislativo 24 aprile 2006, n. 219, recante attuazione della direttiva 2001/83/CE (e successive direttive di modifica) relativa ad un codice comunitario concernente i medicinali per uso umano, e, in particolare l’articolo 142-quinquies;
Visto il decreto legislativo 6 novembre 2007, n. 193, recante attuazione della direttiva 2004/41/CE relativa ai controlli in materia di sicurezza alimentare e applicazione dei regolamenti europei nel medesimo settore e, in particolare, l’articolo 2;
Visto il decreto legislativo 4 febbraio 1993, n. 65, recante attuazione della direttiva 89/437/CE concernente i problemi igienici e sanitari relativi alla produzione ed immissione sul mercato degli ovoprodotti;
Visto il decreto legislativo 19 novembre 2008, n. 194, recante disciplina delle modalita’ di rifinanziamento dei controlli sanitari ufficiali in attuazione del regolamento (CE) n. 882/2004;
Vista la legge 4 giugno 2010, n. 96, recante disposizioni per l’adempimento di obblighi derivanti dall’appartenenza dell’Italia alle Comunita’ europee – Legge comunitaria 2009 e, in particolare, l’articolo 48;
Visto il decreto-legge 13 settembre 2012, n. 158, convertito, con modificazioni, dalla legge 8 novembre 2012, n. 189, recante disposizioni urgenti per promuovere lo sviluppo del Paese mediante un piu’ alto livello di tutela della salute;
Visto il decreto-legge del 9 febbraio 2012, n. 5, convertito, con modificazioni, dalla legge 4 aprile 2012, n. 35, recante disposizioni urgenti in materia di semplificazione e di sviluppo e, in particolare, l’articolo 14;
Visto il decreto del Presidente della Repubblica 14 luglio 1995, recante atto di indirizzo e coordinamento alle regioni e province autonome sui criteri uniformi per l’elaborazione dei programmi di controllo ufficiale degli alimenti e bevande;
Visto il decreto del Presidente della Repubblica 7 aprile 1999, n. 128, concernente il regolamento recante norme per l’attuazione delle direttive 96/5/CE e 98/36/CE sugli alimenti a base di cereali e altri alimenti destinati a lattanti e bambini;
Visto il decreto del Presidente della Repubblica 2 novembre 2001, n. 433, recante regolamento di attuazione delle direttive 96/51/CE, 98/51/CE, 1999/20/CE in materia di additivi nell’alimentazione degli animali;
Visto il decreto legislativo 28 giugno 2012, n. 106, recante riorganizzazione degli enti vigilati dal Ministero della salute, a norma dell’articolo 2 della legge 4 novembre 2010, n. 183;
Visto il decreto legislativo 30 giugno 1993, n. 270, recante riordinamento degli Istituti zooprofilattici sperimentali, a norma dell’articolo 1, comma 1, lettera h), della legge 23 ottobre 1992, n. 421;
Vista la preliminare deliberazione del Consiglio dei ministri, adottata nella riunione del 30 ottobre 2020;
Acquisita l’intesa in sede di Conferenza permanente per i rapporti tra lo Stato, le regioni e le Province autonome di Trento e di Bolzano nella seduta del 3 dicembre 2020;
Acquisiti i pareri delle competenti Commissioni della Camera dei deputati e del Senato della Repubblica;
Vista la deliberazione del Consiglio dei ministri, adottata nella riunione del 29 gennaio 2021;
Sulla proposta del Ministro per gli affari europei e del Ministro della salute, di concerto con i Ministri degli affari esteri e della cooperazione internazionale, della giustizia, dell’economia e delle finanze, per gli affari regionali e le autonomie, delle politiche agricole alimentari e forestali ad interim, dello sviluppo economico e della difesa;
Emana
il seguente decreto legislativo:
Art. 1
Finalita’
1. Il presente decreto legislativo e’ finalizzato a adeguare e
raccordare le disposizioni nazionali vigenti alle disposizioni del
regolamento (UE) 2017/625, di seguito Regolamento.
Art. 2
Autorita’ competenti e altro personale
afferente alle autorita’ competenti
1. Il Ministero della salute, le regioni, le Provincie autonome di
Trento e Bolzano, le Aziende sanitarie locali, nell’ambito delle
rispettive competenze, sono le Autorita’ competenti designate, ai
sensi dell’articolo 4 del Regolamento, a pianificare, programmare,
eseguire, monitorare e rendicontare i controlli ufficiali e le altre
attivita’ ufficiali nonche’ procedere all’adozione delle azioni
esecutive previste dagli articoli 137 e 138 del Regolamento, e ad
accertare e contestare le relative sanzioni amministrative nei
seguenti settori:
a) alimenti, inclusi i nuovi alimenti, e la sicurezza alimentare,
in tutte le fasi della produzione, della trasformazione e della
distribuzione di alimenti comprese le norme relative alle indicazioni
nutrizionali e il loro coinvolgimento nel mantenimento dello stato di
salute fornite sui prodotti alimentari, anche con riferimento ad
alimenti contenenti allergeni e alimenti costituiti, contenenti o
derivati da OGM, nonche’ la fabbricazione e l’uso di materiali e
oggetti destinati a venire a contatto con gli alimenti;
b) mangimi e sicurezza dei mangimi in qualsiasi fase della
produzione, della trasformazione, della distribuzione e dell’uso,
anche con riferimento a mangimi costituiti, contenenti o derivati da
OGM;
c) salute animale;
d) sottoprodotti di origine animale e prodotti derivati ai fini
della prevenzione e della riduzione al minimo dei rischi sanitari per
l’uomo e per gli animali;
e) benessere degli animali;
f) prescrizioni per l’immissione in commercio e l’uso di prodotti
fitosanitari, dell’utilizzo sostenibile dei pesticidi, ad eccezione
dell’attrezzatura per l’applicazione dei pesticidi.
2. Le autorita’ competenti garantiscono il rispetto di quanto
previsto dall’articolo 5 del Regolamento. In particolare, il
Ministero della salute, le regioni, le Province autonome di Trento e
Bolzano e le Aziende sanitarie locali procedono ad uniformare le
competenze ed i profili professionali del personale, anche in modo da
favorirne l’interscambio.
3. Il Ministero delle politiche agricole alimentari e forestali e’
Autorita’ competente ai sensi dell’articolo 4 del Regolamento nei
seguenti settori:
a) alimenti, relativamente alle norme volte a garantire pratiche
commerciali leali e a tutelare gli interessi e l’informazione dei
consumatori, comprese le norme di etichettatura, per i profili privi
di impatto sulla sicurezza degli alimenti, e per i controlli
effettuati a norma dell’articolo 89 del regolamento (UE) n. 1306/2013
del Parlamento europeo e del Consiglio, del 17 dicembre 2013;
b) mangimi, relativamente alle norme volte a tutelare gli aspetti
qualitativi e merceologici, compresa l’etichettatura, per i profili
privi di impatto sulla sicurezza dei mangimi, ma che possono incidere
sulla correttezza e trasparenza delle transazioni commerciali;
c) misure di protezione contro gli organismi nocivi per le
piante;
d) produzione biologica ed etichettatura dei prodotti biologici;
e) uso ed etichettatura delle denominazioni di origine protette,
delle indicazioni geografiche protette e delle specialita’
tradizionali garantite.
4. Il Ministero delle politiche agricole alimentari e forestali
e’ organo di collegamento per lo scambio di comunicazioni tra le
autorita’ competenti degli Stati membri, ai sensi degli articoli da
102 a 107 del Regolamento, nei settori di competenza come individuati
nel comma 2.
5. Il Ministero della salute, e’ l’autorita’ unica, ai sensi
dell’articolo 12, comma 3, lettere b) e d) della legge 4 ottobre
2019, n. 117, per coordinare la collaborazione e i contatti con la
Commissione europea e gli altri Stati membri in relazione ai
controlli ufficiali e alle altre attivita’ ufficiali nei settori di
cui al comma 1.
6. Il Ministero della salute, e’ l’organo di collegamento, ai sensi
dell’articolo 12, comma 3, lettera c) della legge 4 ottobre 2019, n.
117, responsabile di agevolare lo scambio di comunicazioni tra le
Autorita’ competenti in relazione ai controlli ufficiali e alle altre
attivita’ ufficiali nei settori di cui al comma 1.
7. Con riferimento al settore di cui al comma 1, lettere c) ed e),
il Ministero della salute, ai sensi dell’articolo 4, punto 55) del
regolamento (UE) 2016/429, e’ l’Autorita’ centrale responsabile
dell’organizzazione e del coordinamento dei controlli ufficiali e
delle altre attivita’ ufficiali per la prevenzione e il controllo
delle malattie animali trasmissibili.
8. Con riferimento ai settori di cui al comma 1, il Ministero della
difesa e’ Autorita’ competente per i controlli ufficiali e le altre
attivita’ di controllo ufficiale condotte nelle strutture delle Forze
armate, comprese quelle connesse alle attivita’ dei contingenti
impiegati nelle missioni internazionali. Esso puo’ procedere anche a
effettuare controlli ufficiali negli stabilimenti siti al di fuori
delle strutture militari che forniscono merce per le Forze Armate,
previo coordinamento con l’Azienda sanitaria locale competente sullo
stabilimento oggetto di controllo, la quale sara’ destinataria anche
dell’esito di tali controlli. Restano ferme le competenze e le
attribuzioni del servizio sanitario del Corpo della Guardia di
finanza, come stabilite dall’articolo 64 del decreto legislativo 19
marzo 2001, n. 69, nelle strutture che si trovano nella
disponibilita’ del medesimo corpo.
9. Nei settori di cui al comma 1, il Ministero della salute, nel
rispetto del riparto costituzionale delle competenze legislative
dello Stato, delle Regioni e delle Province autonome di Trento e
Bolzano, garantisce il coordinamento, l’uniformita’, l’efficacia e
l’efficienza dei controlli ufficiali e delle altre attivita’
ufficiali tra tutte le Autorita’ competenti sul territorio nazionale
attraverso l’adozione di piani nazionali di controllo pianificati
secondo i principi del presente decreto e del Regolamento.
10. Il Ministero della salute, in qualita’ di Autorita’ competente,
puo’ avvalersi del Comando carabinieri per la tutela della salute,
garantendone il coordinamento delle attivita’ di accertamento con le
attivita’ di controllo svolte dalle altre Autorita’ territorialmente
competenti. Il personale afferente al Comando dei carabinieri per la
tutela della salute, nel caso rilevi la presenza di non conformita’
nei settori di cui al comma 1 del presente articolo, informa
l’Autorita’ competente dei provvedimenti adottati.
11. Al personale delle Autorita’ competenti di cui al comma 1,
addetto ai controlli ufficiali e alle altre attivita’ ufficiali, e’
attribuita la qualifica di Ufficiale o Agente di Polizia Giudiziaria
nei limiti del servizio cui e’ destinato e secondo le attribuzioni ad
esso conferite. Tale personale possiede la qualifica di pubblico
ufficiale e puo’ in ogni caso richiedere, ove occorra, l’assistenza
della forza pubblica.
12. Il personale e le forze di polizia afferenti ad altre
Istituzioni che, nell’ambito dello svolgimento dei controlli condotti
per la propria attivita’ istituzionale, sospettino la presenza di non
conformita’ nei settori di cui al comma 1, ne danno tempestiva
segnalazione alle Autorita’ competenti.
13. L’autorita’ giudiziaria che, nell’ambito di indagini
investigative o programmi di repressione degli illeciti nelle materie
di cui al comma 1, rilevi profili di minaccia alla salute pubblica,
informa le autorita’ competenti al fine di contenere il rischio.
Art. 3
Piano di controllo nazionale pluriennale
1. Il Ministero della salute, designato, ai sensi dell’articolo 12,
comma 3, lettera c) della legge 4 ottobre 2019, n. 117, quale
organismo unico di coordinamento, coordina, individuando modalita’ e
strumenti condivisi le autorita’ competenti responsabili dei
controlli ufficiali nei settori di cui all’articolo 1, comma 2 del
medesimo regolamento, nella predisposizione del Piano di controllo
nazionale pluriennale (PCNP), da approvare ai sensi dell’articolo 2,
comma 1, lettera a) del decreto legislativo 28 agosto 1997, n. 281,
secondo le modalita’ di cui all’articolo 109 del Regolamento.
2. Al fine di assicurare l’omogeneita’ e l’uniformita’ di
comportamento nell’effettuazione dei controlli ufficiali, nel
rispetto dei principi sanciti dal Regolamento, qualora siano
coinvolte diverse Autorita’ competenti, il Ministero della salute
coordina l’attivita’ delle stesse individuando modalita’ e strumenti
condivisi.
3. Le Autorita’ competenti che effettuano controlli ufficiali nei
settori di cui all’articolo 1, comma 2 del Regolamento provvedono a
trasmetterne annualmente, non oltre il 30 aprile, gli esiti al
Ministero della salute. Con decreto del Ministro della salute sono
stabilite le modalita’ di trasmissione.
Art. 4
Controlli ufficiali e altre attivita’ ufficiali
1. Le Autorita’ competenti di cui all’articolo 2, comma 1,
effettuano regolarmente i controlli ufficiali su tutti gli
stabilimenti e le attivita’ dei settori di cui al medesimo comma 1,
in base alla categoria di rischio assegnata e con frequenza adeguata,
tenendo conto dei criteri stabiliti dall’articolo 9, paragrafo 1,
lettere a), b), c), d), ed e) del regolamento.
2. I controlli ufficiali sono eseguiti di norma senza preavviso,
tranne nel caso in cui tale preavviso sia necessario e debitamente
giustificato per l’esecuzione del controllo ufficiale.
3. I controlli ufficiali devono essere eseguiti secondo procedure
documentate, aggiornate secondo necessita’, che contengano istruzioni
per il personale addetto alla esecuzione dei controlli stessi, al
fine di garantirne l’omogeneita’ e l’efficacia.
4. Le Autorita’ competenti mettono in atto procedure per verificare
la coerenza e l’efficacia dei controlli ufficiali e delle altre
attivita’ ufficiali e adottano le azioni correttive in caso di
inadeguatezze.
5. Le Autorita’ competenti elaborano una documentazione scritta del
controllo effettuato, tramite scheda di controllo ufficiale o verbale
o altro documento altrimenti nominato, che puo’ avere anche formato
elettronico. Tale documentazione deve comunque essere resa
disponibile all’operatore.
6. Le Autorita’ competenti effettuano i controlli ufficiali con un
livello elevato di trasparenza e, almeno una volta l’anno, mettono a
disposizione del pubblico le informazioni ai sensi dell’articolo 11,
paragrafo 1 del Regolamento anche mediante la pubblicazione su
internet.
7. Il Ministero della salute esercita le attribuzioni relative ai
settori di cui all’articolo 2, comma 1, in qualita’ di autorita’
competente a garantire la sicurezza e la conformita’ alla normativa
degli alimenti venduti a distanza mediante canali telematici. Il
Ministero della salute e’ l’autorita’ competente a disporre la
cessazione per un periodo di tempo appropriato della totalita’ o di
una parte delle attivita’ dell’operatore interessato e, se del caso,
dei siti internet che gestisce o utilizza cosi’ come previsto
dall’articolo 138, paragrafo 2, lettere i) e j) del Regolamento.
Art. 5
Non conformita’
1. Al fine di adottare provvedimenti proporzionati al rischio
effettivo, le Autorita’ competenti di cui all’articolo 2, comma 1,
valutano le non conformita’ rilevate nel corso dei controlli
ufficiali e delle altre attivita’ ufficiali. Si definiscono come:
a) non conformita’ minori (nc) quelle che non comportano un
rischio immediato per la salute umana o per la salute e il benessere
degli animali;
b) non conformita’ maggiori (NC) quelle che comportano un rischio
immediato per la salute umana o per la salute e il benessere degli
animali.
2. Al fine di tutelare la salute pubblica, le Autorita’ competenti
di cui all’articolo 2, comma 1, tra le altre misure previste dagli
articoli 137 e 138 del Regolamento, possono procedere ad una delle
seguenti tipologie di sequestro o blocco ufficiale di attrezzature,
locali, merci o animali:
a) sequestro amministrativo nei casi previsti dall’articolo 13
della legge n. 689 del 1981;
b) sequestro penale nei casi di rilevazione di illeciti penali;
c) blocco ufficiale ai sensi degli articoli 137 e 138 del
Regolamento nei casi residuali.
Art. 6
Obblighi degli operatori
1. Nei limiti di quanto necessario allo svolgimento dell’attivita’
di controllo ufficiale e delle altre attivita’ ufficiali, compresa
l’attivita’ di certificazione ufficiale, gli operatori dei settori di
cui all’articolo 2, comma 1, assicurano alle autorita’ competenti o,
qualora individuati, agli organismi delegati o designati, l’accesso:
a) alle attrezzature, ai mezzi di trasporto, ai locali e agli
altri luoghi sotto il loro controllo e relative adiacenze;
b) ai propri sistemi informatici di trattamento delle
informazioni;
c) agli animali e alle merci sotto il loro controllo;
d) ai propri documenti, anche informatizzati, e a tutte le altre
informazioni pertinenti.
2. Ove non sia necessario il riconoscimento ai sensi della
normativa di settore, gli operatori dei settori di cui all’articolo
2, comma 1, prima dell’avvio delle attivita’ procedono ad effettuare
la notifica all’Autorita’ competente comunicando almeno:
a) nome, denominazione sociale e forma giuridica;
b) descrizione delle specifiche attivita’ svolte, comprese quelle
effettuate mediante tecniche di comunicazione a distanza;
c) l’indirizzo del luogo di svolgimento dell’attivita’, ove
effettuata in sede fissa.
3. L’Autorita’ competente stabilisce inoltre i casi in cui per
l’avvio delle attivita’ e’ necessaria la presentazione di ulteriore
documentazione e i casi di esclusione dall’obbligo della notifica
allorquando l’operatore e’ gia’ registrato in altri elenchi.
4. Gli operatori che conducono stabilimenti registrati o
riconosciuti comunicano alle Autorita’ competenti di cui all’articolo
2, comma 1, secondo le modalita’ da questa previste, ogni variazione
dei dati di cui ai commi 2 e 3.
5. Durante i controlli ufficiali e le altre attivita’ ufficiali,
gli operatori forniscono assistenza e collaborano con il personale
delle autorita’ competenti di cui all’articolo 2 del presente
decreto, nell’adempimento dei rispettivi compiti.
6. Gli operatori sono tenuti ad assicurare che le Autorita’
competenti di cui all’articolo 2, comma 1, possano prelevare
gratuitamente, nell’ambito dei controlli ufficiali e delle altre
attivita’ ufficiali, una quantita’ sufficiente di matrici per
consentire la formazione di campioni per l’analisi secondo quanto
disposto dall’articolo 34 del Regolamento.
7.Gli operatori assicurano che il personale operante presso gli
stabilimenti sotto il proprio controllo abbia ricevuto una formazione
adeguata alle mansioni svolte nel rispetto di quanto previsto dalle
normative di settore di cui all’articolo 2, comma 1. Sono fatte salve
le norme che prevedono il possesso di una attestazione specifica per
l’esecuzione di determinate attivita’.
Art. 7
Controperizia
1. Se opportuno, pertinente e tecnicamente fattibile, le Autorita’
competenti di cui all’articolo 2, comma 1 assicurano che, nel
prelevare il campione, ne sia prelevata una quantita’ sufficiente per
rendere disponibili tutte le aliquote previste, compresa quella
destinata all’operatore per consentire allo stesso l’esame di parte
presso un laboratorio di sua fiducia accreditato e quella per
consentirgli l’espletamento dell’eventuale fase relativa alla
controversia. Queste ultime aliquote non vengono prelevate in caso di
espressa rinuncia dell’operatore o di un suo legale rappresentante,
rinuncia che deve essere annotata nel verbale di prelievo. In assenza
di disposizioni specifiche europee e nazionali il campionamento viene
effettuato secondo quanto riportato nell’allegato 1. Per ciascun
campione prelevato e’ compilato a cura dell’autorita’ competente un
verbale di campionamento secondo le indicazioni riportate
nell’allegato 1.
2. Qualora l’esito dell’analisi, prova o diagnosi da condurre non
assicuri la riproducibilita’ dell’esito analitico, in considerazione
della prevalenza e della distribuzione del pericolo negli animali o
nelle merci, della deperibilita’ dei campioni o delle merci, come nel
caso delle analisi microbiologiche finalizzate alla verifica dei
criteri di sicurezza alimentare di cui alla normativa comunitaria e
nazionale e per la ricerca di agenti patogeni negli altri settori di
cui all’articolo 2, comma 1 del presente decreto, l’Autorita’
competente procede al prelievo del campione in un’unica aliquota
specificando nel verbale di campionamento i relativi motivi che
escludono la opportunita’, la pertinenza o la fattibilita’ tecnica
della ripetizione dell’analisi o della prova. Ai campioni di cui al
presente comma non si applicano le disposizioni dell’articolo 223 del
decreto legislativo n. 271 del 1989.
3. Il laboratorio ufficiale deve comunicare tempestivamente
all’Autorita’ competente il risultato delle analisi, prove, diagnosi.
4. L’Autorita’ competente effettua la valutazione del risultato e
comunica il piu’ tempestivamente possibile alle parti interessate
l’esito favorevole o sfavorevole delle analisi, prove, diagnosi.
5. Gli operatori dei settori di cui all’articolo 2, comma 1 i cui
animali o merci sono stati oggetto di controllo ufficiale mediante
campionamento con esito sfavorevole, ai sensi dell’articolo 35 del
Regolamento hanno diritto, a proprie spese, di fare condurre una
controperizia a cura di un esperto di parte qualificato, consistente
nell’esame documentale delle registrazioni inerenti le attivita’
condotte dal momento del campionamento sino all’emissione del
rapporto di prova relativo alla singola analisi, prova o diagnosi.
L’esame documentale viene richiesto all’Autorita’ competente che ha
effettuato il campionamento entro il termine perentorio di quindici
giorni dal ricevimento della comunicazione dell’esito sfavorevole.
Rientra nella controperizia l’esecuzione a proprie spese presso un
laboratorio accreditato di propria fiducia dell’analisi, prova o
diagnosi fatta effettuare dall’operatore sull’aliquota eventualmente
resa disponibile al momento del campionamento.
6. Le disposizioni di cui ai commi precedenti, non pregiudicano
l’obbligo delle Autorita’ competenti di intervenire rapidamente per
eliminare o limitare i rischi sanitari per l’uomo, per gli animali e
per le piante, o i rischi per il benessere degli animali o,
relativamente agli OGM e ai prodotti fitosanitari e ai sottoprodotti
di origine animale, anche i rischi per l’ambiente.
7. Le disposizioni del presente articolo non si applicano alle
altre attivita’ ufficiali di cui all’articolo 2, paragrafo 2 del
Regolamento.
Art. 8
Controversia
1. L’operatore dei settori di cui all’articolo 2, comma 1, che a
seguito di controperizia effettuata con le modalita’ di cui
all’articolo 7, comma 5 non condivida le valutazioni dell’autorita’
competente in merito alla non conformita’ puo’ attivare, entro il
termine perentorio di trenta giorni dal ricevimento della
comunicazione dell’esito sfavorevole, la procedura di controversia,
richiedendo alle autorita’ competenti di potere far effettuare, a
proprie spese, il riesame della documentazione relativa alla analisi,
prova o diagnosi iniziale da parte dell’Istituto superiore di sanita’
(ISS). All’istanza l’operatore dovra’ allegare la ricevuta del
pagamento eseguito a favore dell’ISS per le prestazioni richieste.
L’ISS si esprime entro trenta giorni dal ricevimento della
documentazione, trasmettendo l’esito della valutazione documentale
alle parti interessate, all’Autorita’ competente e, per conoscenza,
al laboratorio ufficiale che ha effettuato la prima analisi, prova o
diagnosi.
2. Con apposita istanza e a proprie spese l’operatore, entro il
termine perentorio di trenta giorni dal ricevimento dell’esito della
valutazione della documentazione da parte dell’ISS, puo’ chiedere
allo stesso ISS, utilizzando l’eventuale apposita aliquota del
campione di cui all’articolo 7, comma 1 del presente decreto,
un’altra analisi, prova o diagnosi. All’atto della richiesta dovra’
essere allegata la ricevuta di pagamento a favore dell’ISS secondo
quanto previsto dalla normativa vigente.
3. L’ISS procede alla ripetizione dell’analisi, anche avvalendosi,
laddove lo ritenga opportuno, di un altro laboratorio ufficiale,
dallo stesso individuato, comunque diverso da quello che ha condotto
la prima analisi prova o diagnosi.
4. L’Istituto superiore di sanita’, entro sessanta giorni dal
ricevimento dell’istanza, notifica all’operatore gli esiti della
ripetizione dell’analisi prova o diagnosi effettuata in sede di
controversia con le modalita’ stabilite agli articoli 137 e seguenti
del c.p.c.. Gli esiti vengono comunicati anche all’Autorita’
competente che ha disposto il campionamento per l’adozione di
eventuali ulteriori provvedimenti e al laboratorio ufficiale che ha
eseguito la prima analisi, prova o diagnosi.
5. Nei settori di cui all’articolo 2, comma 1, le procedure di
controversia contenute nel presente articolo sostituiscono:
a) quelle stabilite dall’articolo 15 della legge 24 novembre
1981, n. 689, ivi compresa la revisione d’analisi;
b) quelle stabilite dall’articolo 223 del decreto legislativo 28
luglio 1989, n. 271.
Art. 9
Laboratori ufficiali
1. Ai sensi dell’articolo 37 del Regolamento sono individuati, nei
settori di competenza del Ministero della salute di cui all’articolo
2, comma 1, i seguenti laboratori ufficiali:
a) l’Istituto superiore di sanita’ (ISS);
b) gli Istituti zooprofilattici sperimentali (IIZZSS);
c) i Laboratori di sanita’ pubblica delle unita’ sanitarie
locali;
d) i Laboratori delle agenzie per la protezione dell’ambiente
(ARPA);
e) i Laboratori designati quali laboratori nazionali di
riferimento (LNR).
2. I Laboratori di cui al comma 1 operano in rete.
3. Il Ministero della salute, puo’ designare come laboratori
ufficiali, anche altri laboratori all’uopo individuati, che siano in
possesso dei requisiti di cui all’articolo 37, paragrafo 4 del
Regolamento e che opereranno in rete.
4. I laboratori di cui ai commi 1 e 3, effettuano analisi, prove e
diagnosi sui campioni prelevati durante i controlli ufficiali e
durante le altre attivita’ ufficiali. Partecipano alle prove
comparative interlaboratorio organizzate dai laboratori nazionali di
riferimento e dai laboratori di riferimento dell’Unione europea.
5. Le Autorita’ competenti inviano i campioni ai laboratori
ufficiali insistenti nel territorio di propria competenza. I
laboratori ufficiali operano in rete per garantire in ogni caso
l’effettuazione delle analisi, prove o diagnosi. I costi delle
analisi, prove o diagnosi effettuate avvalendosi di un altro
laboratorio ufficiale della rete dei laboratori ufficiali, sono a
carico del laboratorio richiedente e rientrano nel finanziamento del
Sistema sanitario regionale.
6. I laboratori ufficiali iscritti negli elenchi regionali dei
laboratori di autocontrollo, che, ai sensi dell’articolo 1, comma 6,
del decreto legislativo 30 giugno 1993, n. 270 e dell’articolo 9,
comma 2, del decreto legislativo 28 giugno 2012, n. 106, svolgono
analisi, prove e diagnosi per gli operatori dei settori di cui
all’articolo 2, comma 1 del presente decreto, devono adottare misure
specifiche atte a garantire l’imparzialita’ e l’assenza di conflitto
di interessi nello svolgimento dei compiti in qualita’ di laboratorio
ufficiale. Tali misure devono essere rese note anche attraverso la
pubblicazione nella sezione trasparenza dei rispettivi siti web.
7. Le misure di cui al comma 6, devono assicurare che le risorse
umane, strutturali e finanziarie destinate alle attivita’ effettuate
nell’ambito del controllo ufficiale siano processualmente distinte da
quelle utilizzate nell’ambito dell’attivita’ di autocontrollo, con
centri di responsabilita’ differenti.
8. Il Ministero della salute, tenendo anche conto della valutazione
dell’organismo nazionale di accreditamento, puo’ pianificare con le
Autorita’ regionali competenti gli audit dei laboratori ufficiali in
conformita’ all’articolo 39 del Regolamento. Le Regioni e le Province
autonome possono procedere ad organizzare ed eseguire autonomamente
audit o altre attivita’ di controllo sui laboratori ufficiali
insistenti sul territorio regionale o della provincia autonoma di cui
alle lettere c) e d) del comma 1.
9. Il Ministero della salute puo’ procedere ad audit presso le
strutture dei laboratori nazionali di riferimento per verificare i
requisiti richiesti dagli articoli 100 e 101 del Regolamento.
10. Il Ministero della salute, nell’ambito degli audit effettuati
ai sensi dei commi 8 e 9, verifica, tra l’altro, le misure e le
procedure adottate per le finalita’ di cui al comma 6.
11. La ricerca delle trichinelle, oltre che nei laboratori di cui
al comma 1, puo’ essere effettuata anche nei laboratori annessi agli
stabilimenti di macellazione e ai centri di lavorazione selvaggina
designati dall’Autorita’ competente per l’esecuzione di tale ricerca.
Tali laboratori possono effettuare la ricerca delle trichinelle anche
per altri stabilimenti di macellazione e per i centri di lavorazione
selvaggina.
12. Ove ricorrano le condizioni stabilite dall’articolo 40,
paragrafo 1, lettera a) del Regolamento, l’Autorita’ competente puo’
designare laboratori annessi agli stabilimenti di macellazione e ai
centri di lavorazione selvaggina che non siano in possesso
dell’accreditamento.
Art. 10
Laboratori nazionali di riferimento
1. Per tutelare la salute pubblica e garantire la sicurezza
alimentare in base a quanto previsto dalla normativa vigente, il
Ministero della salute, quale Autorita’ competente, nei settori di
cui all’articolo 2, comma 1 del presente decreto, designa i
laboratori nazionali di riferimento (LNR) per alimenti, mangimi,
sanita’ animale e formulati fitosanitari. Nell’individuazione di tali
LNR per ciascuno degli agenti patogeni e degli ambiti della sicurezza
alimentare ritenuti prioritari, si tiene conto della presenza di
eventuali Centri di referenza nazionale.
2. I laboratori nazionali di riferimento designati dal Ministero
della salute continuano a svolgere la loro attivita’ in conformita’
alla normativa vigente. L’elenco dei laboratori nazionali di
riferimento e’ aggiornato ogni cinque anni e ogni anno gli stessi
laboratori forniscono al Ministero della salute una relazione sulle
attivita’ svolte.
3. I laboratori ufficiali trasmettono al relativo laboratorio
nazionale di riferimento o al Centro di referenza nazionale i ceppi
di microrganismi patogeni isolati nell’ambito del controllo ufficiale
e delle altre attivita’ ufficiali o le sequenze dell’intero genoma.
Le stesse sequenze sono essere trasmesse anche al Centro di referenza
nazionale per le sequenze genomiche di microrganismi patogeni.
4. Il Ministero della salute, in accordo con i Laboratori Nazionali
di riferimento o i Centri di referenza nazionale, sulla base
dell’evoluzione tecnico scientifica e di particolari situazioni
epidemiologiche, individua i criteri con cui vengono selezionati gli
isolati dei microrganismi per i quali e’ necessario effettuare il
sequenziamento genomico.
5. I laboratori ufficiali che isolano i microrganismi di cui al
precedente comma 4, sottopongono a sequenziamento genomico completo i
microrganismi isolati e provvedono a inviare le relative sequenze e i
relativi metadati al laboratorio nazionale di riferimento e al Centro
di referenza nazionale per le sequenze genomiche di microrganismi
patogeni.
Art. 11
Laboratori di autocontrollo del settore mangimistico
1. I laboratori non annessi agli stabilimenti del settore mangimi
che effettuano analisi nell’ambito delle procedure di autocontrollo
ed i laboratori annessi agli stabilimenti del settore mangimi che
effettuano analisi ai fini dell’autocontrollo per conto di altri
operatori del settore mangimi devono essere accreditati, secondo la
norma UNI CEI EN ISO/IEC 17025, per le singole prove o gruppi di
prove, da un organismo di accreditamento riconosciuto e operante ai
sensi della norma UNI CEI EN ISO/IEC 17011.
2. Le regioni e le Province autonome di Trento e di Bolzano
iscrivono in appositi elenchi i laboratori di cui al comma 1 presenti
sul proprio territorio e ne curano almeno annualmente la
pubblicazione e la trasmissione aggiornata al Ministero della salute
per la pubblicazione nell’elenco nazionale.
Art. 12
Anagrafe degli stabilimenti e degli operatori e banche dati relative
ai controlli ufficiali
1. Le Autorita’ competenti assicurano che gli stabilimenti e gli
operatori riconosciuti, registrati o comunque autorizzati ai sensi
delle normative vigenti relative ai settori di cui all’articolo 2,
comma 1, siano inseriti nel sistema informativo del Ministero della
salute o in altri sistemi in uso alle Autorita’ competenti regionali
o locali ad esso collegati tramite cooperazione applicativa.
2. Con decreto del Ministro della salute sono stabilite le
modalita’ tecniche e operative per la realizzazione o l’adeguamento,
da parte delle Autorita’ competenti, degli applicativi ovvero degli
strumenti per la condivisione delle informazioni tra i Sistemi
Informativi di cui al comma 1, anche al fine di ottimizzare le
risorse, evitare la duplicazione e la difformita’ dei dati e
garantire il loro tempestivo aggiornamento.
3. Le Autorita’ competenti assicurano che i dati e le informazioni
riguardanti le attivita’ di controllo ufficiale e le altre attivita’
ufficiali, relative ai settori di cui all’articolo 2 comma 1, siano
inseriti nel Sistema Informativo del Ministero della salute o in
altri sistemi in uso alle Autorita’ competenti regionali o locali ad
esso collegati tramite cooperazione applicativa.
Art. 13
Disposizioni in materia di navi officina e di navi frigorifero
1. All’articolo 48 della legge 4 giugno 2010, n. 96, il comma 1 e’
sostituito dal seguente: «1. Il Ministero della salute riconosce, ai
sensi dell’articolo 4 del regolamento (CE) n. 853/2004 del Parlamento
europeo e del Consiglio, del 29 aprile 2004, le navi officina, le
navi frigorifero e le navi reefer ed effettua sulle stesse i
controlli ufficiali previsti dal regolamento (UE) n. 2017/625.
Laddove le navi operano in acque non territoriali i controlli
ufficiali, su richiesta dell’operatore ed a sue spese, possono essere
fatti in acque internazionali».
Art. 14
Disposizioni in materia di registrazione dei trattamenti di cui al
decreto legislativo 6 aprile 2006, n. 193 e al decreto legislativo
16 marzo 2006, n. 158
1. Al fine di assicurare il completamento del sistema informatico
di tracciabilita’ dei medicinali veterinari, dei mangimi medicati e
dei prodotti intermedi disciplinato dagli articoli 89 e 118 del
decreto legislativo del 6 aprile 2006, n. 193 e dall’articolo 8 del
decreto legislativo del 3 marzo 1993, n. 90, a far data dal 28
gennaio 2022, data di applicazione del regolamento (UE) n. 2019/6, le
registrazioni dei trattamenti di cui all’articolo 79 del decreto
legislativo n. 193 del 2006 e di cui agli articoli 4 e 15 del decreto
legislativo n.158 del 2006 avvengono esclusivamente in formato
elettronico.
2. Con decreto del Ministro della salute, previa intesa della
Conferenza permanente dei rapporti tra Stato, regioni e province
autonome, sono definiti i criteri e le modalita’ operative delle
registrazioni in formato elettronico.
Art. 15
Modifiche al decreto legislativo 16 marzo 2006, n. 158
1. Al decreto legislativo 16 marzo 2006, n. 158, sono apportate le
seguenti modifiche:
a) il comma 2 dell’articolo 1 e’ sostituito dal seguente: «2. Ai
fini del presente decreto si applicano le definizioni previste dal
regolamento (CE) n. 178/2002, dal regolamento (CE) n. 852/2004, dal
regolamento (CE) n. 853/2004, dal decreto legislativo 6 aprile 2006,
n. 193, dal regolamento (UE) 2016/429, dal regolamento (UE) 2017/625,
dal regolamento (UE) 2019/6, dal regolamento (UE) 2019/2090. Nel
presente decreto, qualsiasi riferimento al termine «azienda», deve
intendersi riferito al termine: «stabilimento» di cui al regolamento
(UE) 2016/429 e «tempo di sospensione» deve intendersi riferito al
termine: «tempo di attesa» di cui al decreto legislativo 6 aprile
2006, n. 193.»;
b) all’articolo 1, comma 3, le lettere a), c), d), g), h), i),
l), m), n), o), q) sono abrogate;
c) all’articolo 4, i commi 3 e 4 sono sostituiti dai seguenti:
«3. I trattamenti di cui al comma 1, devono essere registrati
entro 48 ore elettronicamente dal veterinario che ha in cura gli
animali nella banca dati centrale, finalizzata a monitorare le
confezioni dei medicinali all’interno del sistema distributivo,
istituita ai sensi del decreto del Ministro della salute 15 luglio
2004, pubblicato nella Gazzetta Ufficiale n. 2 del 4 gennaio 2005, o
annotati su un registro cartaceo tenuto nell’azienda vidimato dal
servizio veterinario della azienda unita’ sanitaria locale competente
per territorio. In esso sono annotate le seguenti informazioni:
a) numero e PIN della ricetta di riferimento;
b) data di inizio e fine trattamento.
4. Il registro di cui al comma 3 deve essere conservato
nell’azienda a cura del titolare, per almeno cinque anni e messo a
disposizione dell’autorita’ competente.»;
d) all’articolo 5, il comma 4 e’ sostituito dal seguente: «4.
Fino al 28 gennaio 2022, in caso di allevamenti che non abbiano
optato per il registro informatizzato, i trattamenti di cui al comma
1 e all’articolo 4, comma 1, devono essere comunicati entro tre
giorni, dal veterinario che li effettua direttamente al servizio
veterinario dell’azienda unita’ sanitaria locale competente per
territorio, con l’indicazione dell’ubicazione dell’azienda, del
detentore degli animali, del numero identificativo degli animali
sottoposti a trattamento, del medicinale veterinario impiegato e del
relativo tempo di attesa, della data e del tipo di intervento
eseguito.»;
e) all’articolo 11, al comma 1, le parole «e degli articoli
12 e 13» sono sostituite dalle seguenti: «, dell’articolo 12 e degli
allegati al presente decreto.»;
f) all’articolo 12, comma 2, la lettera d) e’ sostituita
dalla seguente: «d) trasmette annualmente alla Commissione europea e
ad EFSA, secondo le procedure condivise in ambito europeo e indicate
dalla Commissione europea, il Piano per l’anno in corso e i risultati
del Piano dell’anno precedente.»;
g) gli articoli 13, 16, 17, 18, 19, 21, 22, 23, 24, 25, 26,
27, 28, 30, 31, 33, 34 e 35 sono abrogati;
h) l’articolo 14 e’ sostituito dal seguente:
«Art. 14 (Obblighi per gli operatori). – 1. Il titolare
dell’azienda di cui all’articolo 1, comma 2, se non gia’ registrato
presso il servizio veterinario dell’azienda unita’ sanitaria locale
competente per territorio ai sensi delle normative vigenti, deve
chiedere la registrazione presso il predetto servizio.
2. Il responsabile delle aziende e degli stabilimenti puo’
commercializzare soltanto:
a) animali ai quali non siano stati somministrati sostanze o
prodotti non autorizzati, ovvero che non siano stati oggetto di un
trattamento illecito;
b) animali per i quali, in caso di somministrazione di
sostanze o prodotti autorizzati, sia stato rispettato il periodo di
attesa prescritto. Nell’ipotesi di mancato rispetto del periodo di
attesa prescritto e’ consentito l’esclusivo invio degli animali verso
altri allevamenti;
c) prodotti provenienti dagli animali di cui alle lettere a)
e b).»;
i) l’articolo 15 e’ sostituito dal seguente:
«Art. 15 (Registrazioni da effettuare a cura dei veterinari e
degli allevatori). – 1. La data, la natura dei trattamenti
terapeutici prescritti o eseguiti, l’identificazione degli animali
trattati, comprensiva della categoria, definita dai sistemi
informativi ministeriali e i tempi di attesa corrispondenti devono
essere registrati entro 48 ore elettronicamente dal veterinario che
ha in cura gli animali nella banca dati centrale finalizzata a
monitorare le confezioni dei medicinali all’interno del sistema
distributivo, istituita ai sensi del decreto del Ministro della
salute 15 luglio 2004 o, fino al 28 gennaio 2022, annotati, al
momento dell’emissione della prescrizione o dell’autorizzazione
all’utilizzo, su un registro cartaceo, diverso da quello
dall’articolo 4, comma 3, tenuto nell’azienda, vidimato dal servizio
veterinario della azienda unita’ sanitaria locale competente per
territorio, in cui riportare numero e PIN della ricetta di
riferimento e, in aggiunta, la natura dei trattamenti e
l’identificazione degli animali sottoposti a trattamento, comprensiva
della categoria, qualora le stesse informazioni non siano desumibili
dalla prescrizione.
2. L’allevatore registra elettronicamente nella banca dati
centrale, finalizzata a monitorare le confezioni dei medicinali
all’interno del sistema distributivo, istituita ai sensi del citato
decreto del Ministro della salute 15 luglio 2004 o, fino al 28
gennaio 2022, annota su registro cartaceo di cui al comma 1, la data
di inizio e di fine trattamento entro le 48 ore dall’inizio e dalla
fine del trattamento e l’identificazione degli animali, comprensiva
della categoria, effettivamente sottoposti a trattamento.
3. Il registro di cui ai commi 1 e 2 puo’ coincidere con il
registro previsto dall’articolo 79 del decreto legislativo 6 aprile
2006, n. 193. In caso di annotazione cartacea il registro deve essere
vidimato dall’autorita’ competente e detenuto in azienda e
conservato, a cura del titolare della stessa, almeno per cinque anni.
4. Il veterinario della azienda sanitaria locale competente,
nel corso del controllo ufficiale sugli allevamenti, controlla la
corretta effettuazione dei trattamenti previsti dal presente decreto
inserendo nei registri la data e ora del controllo delle verifiche
effettuate.
5. Gli allevatori ed i veterinari che hanno in cura gli animali
sono tenuti a fornire all’autorita’ competente, su sua richiesta,
ogni informazione relativa al rispetto delle norme di cui al presente
decreto.
6. Per gli animali introdotti negli stabilimenti di
macellazione, pubblici e privati, a scopo di macellazione, devono
essere assicurati gli obblighi inerenti l’identificazione e la
registrazione, con la compilazione della dichiarazione di provenienza
e destinazione degli animali (modello 4) di cui al decreto del
Presidente della Repubblica 30 aprile 1996, n. 317, secondo le
modalita’ previste dal decreto del Ministro della salute 28 giugno
2016, pubblicato nella Gazzetta Ufficiale n. 205 del 2 settembre
2016, contenente le seguenti indicazioni:
a) numero, specie e categoria degli animali;
b) ubicazione dell’allevamento di provenienza;
c) che gli animali non sono stati trattati o alimentati con
sostanze di cui e’ vietato l’impiego;
d) eventuali trattamenti effettuati sugli animali, nei
novanta giorni precedenti l’avvio alla macellazione, con le sostanze
di cui agli articoli 4 e 5, nonche’ con alimenti medicamentosi e
specialita’ medicinali;
e) che sono stati osservati i previsti periodi di attesa per
i trattamenti con i prodotti di cui alla lettera d)»;
l) all’articolo 20:
1. il comma 1, e’ sostituito dal seguente: «1. Tutti i campioni
sono prelevati e analizzati conformemente al regolamento (UE)
2017/625, alle decisioni 1998/179/CE, 97/747/CE, 2002/657/CE della
Commissione e agli allegati del presente decreto. I campioni devono
essere analizzati dagli Istituti zooprofilattici sperimentali, o, in
casi particolari, da altri laboratori eventualmente individuati dal
Ministero.»;
2. i commi 2, 3, 4 sono abrogati;
m) all’articolo 29 sono abrogati: le lettere b) e c) del comma 1
e il comma 2;
n) all’articolo 32:
1) il comma 1 e’ sostituito dal seguente: «1. Chiunque viola le
disposizioni di cui agli articoli 2, 3, comma 1, 4, commi 5 e 6, 5,
commi 3 e 5, 7, comma 3, 10, 14, comma 2, e’ punito con la sanzione
amministrativa pecuniaria da 10.329 euro a 61.974 euro.»;
2) il comma 3 e’ sostituito dal seguente: «3. Salvo che il
fatto costituisca reato, chiunque viola le disposizioni di cui agli
articoli 3, comma 2, 7, comma 2 e 14, comma 1, e’ punito con la
sanzione amministrativa pecuniaria da 5.164 euro a 30.987 euro.»;
3) il comma 4 e’ sostituito dal seguente; «4. Salvo che il
fatto costituisca reato, chiunque viola le disposizioni di cui agli
articoli 4, commi 3 e 4, 5, comma 4, 8, comma 1, 15, commi 1, 3 e 6,
e’ punito con la sanzione amministrativa pecuniaria da 2.037 euro a
12.394 euro.»;
4) dopo il comma 4 e’ inserito il seguente: «4-bis. Salvo che
il fatto costituisca reato, chiunque viola le disposizioni di cui
all’articolo 15, comma 2 e’ punito con la sanzione amministrativa
pecuniaria da 150 euro a 600 euro.».
Art. 16
Disposizioni in materia di macellazione
per il consumo domestico privato
1. Al fine di consentire il mantenimento a livello nazionale di
metodi e consumi tradizionali, e’ consentita la macellazione per
autoconsumo al di fuori di stabilimenti registrati o riconosciuti. Le
regioni disciplinano la pratica della macellazione per autoconsumo,
nel rispetto dei seguenti principi:
a) divieto di commercializzazione delle carni e dei prodotti
ottenuti dalla macellazione degli animali;
b) rispetto del benessere animale e divieto di macellazione
rituale che non preveda lo stordimento degli animali;
c) predisposizione di procedure regionali per la prevenzione
delle zoonosi;
d) possibilita’, da parte dei Servizi veterinari dell’ASL, di
effettuare controlli a campione per verificare il rispetto delle
condizioni di salute degli animali, di benessere animale, di igiene
della macellazione e di corretto smaltimento dei sottoprodotti.
2. Le specie animali oggetto di macellazione per autoconsumo sono
esclusivamente le seguenti:
a) pollame, lagomorfi e piccola selvaggina allevata;
b) ovini e caprini;
c) suidi;
d) bovidi.
3. I privati che intendono macellare o far macellare ai sensi del
presente articolo devono comunicare all’autorita’ competente locale
il luogo e la data della macellazione. L’attuazione delle
disposizioni di cui al presente articolo non determinano nuovi ne’
maggiori oneri a carico della finanza pubblica trattandosi di spese
che sono a carico degli operatori privati.
Art. 17
Disposizioni in materia di alimenti addizionati di vitamine e
minerali e altre sostanze ai sensi del regolamento (CE) 1925/2006.
1. Gli operatori del settore alimentare notificano al momento
dell’immissione in commercio al Ministero della salute gli alimenti
addizionati di vitamine e minerali, come definiti dal regolamento
(CE) 1925/2006, secondo le procedure di notifica previste dal
Ministero della salute.
Art. 18
Abrogazioni
1. Sono abrogati i seguenti provvedimenti:
a) regio decreto 20 dicembre 1928, n. 3298, recante approvazione
del regolamento per la vigilanza sanitaria delle carni;
b) legge 30 aprile 1962, n. 283, recante modifica degli articoli
242, 243, 247, 250 e 262 del testo unico delle leggi sanitarie,
approvato con regio decreto 27 luglio 1934, n. 1265: disciplina
igienica della produzione e della vendita delle sostanze alimentari e
delle bevande, fatte salve le disposizioni di cui agli articoli 7, 10
e 22;
c) legge 26 febbraio 1963, n. 441, recante modifiche ed
integrazioni alla legge n. 283 del 1962, fatta salva la disposizione
di cui all’articolo 7;
d) decreto del Presidente della Repubblica 26 marzo 1980, n. 327,
recante regolamento di esecuzione della legge 30 aprile 1962, n. 283,
e successive modificazioni, in materia di disciplina igienica della
produzione e della vendita delle sostanze alimentari e delle bevande;
e) decreto legislativo 27 gennaio 1992, n. 110, recante
attuazione della direttiva 89/108/CEE in materia di alimenti
surgelati destinati all’alimentazione umana, limitatamente
all’articolo 10 recante importazione alimenti surgelati provenienti
da Paesi non appartenenti alla CEE;
f) decreto Presidente della Repubblica 14 luglio 1995, recante
atto di indirizzo e coordinamento alle regioni e province autonome
sui criteri uniformi per l’elaborazione dei programmi di controllo
ufficiale degli alimenti e bevande;
g) decreto del Ministro della sanita’ 12 gennaio 1996, n. 119,
recante regolamento concernente l’impiego di sale alimentare nelle
paste alimentari fresche e secche e nelle paste alimentari speciali
con o senza ripieno;
h) articolo 8 del decreto-legge 18 giugno 1986, n. 282,
convertito, con modificazioni, dalla legge 7 agosto 1986, n. 462,
recante misure urgenti in materia di prevenzione e repressione delle
sofisticazioni alimentari;
i) decreto legislativo 3 marzo 1993, n. 123, recante attuazione
della direttiva 89/397/CEE relativa al controllo ufficiale dei
prodotti alimentari;
l) articolo 8, comma 16-quater del decreto-legge 13 settembre
2012, n. 158, convertito, con modificazioni, dalla legge 8 novembre
2012, n. 189, recante disposizioni urgenti per promuovere lo sviluppo
del Paese mediante un piu’ alto livello di tutela della salute;
m) decreto legislativo 26 maggio 1997, n. 156, recante attuazione
della direttiva 93/99/CEE, concernente misure supplementari in merito
al controllo ufficiale dei prodotti alimentari;
n) decreto legislativo 13 aprile 1999, n. 123, recante attuazione
della direttiva 95/69/CE che fissa le condizioni e le modalita’ per
il riconoscimento e la registrazione di taluni stabilimenti e
intermediari operanti nel settore dell’alimentazione degli animali;
o) decreto del Presidente della Repubblica 2 novembre 2001, n.
433, recante regolamento di attuazione delle direttive 96/51/CE,
98/51/CE, 1999/20/CE in materia di additivi nell’alimentazione degli
animali;
p) decreto legislativo 24 febbraio 1997, n. 45, recante
attuazione delle direttive 93/74/CEE, 94/39/CE, 95/9/CE e 95/10/CE in
materia di alimenti dietetici per animali, limitatamente agli
articoli 1, 2, 3, comma 1, lettere a) e b), comma 2 e commi 3, 4, 5,
6 e all’allegato II;
q) decreto del Presidente della Repubblica 10 febbraio 1998, n.
214, recante regolamento recante norme di attuazione della direttiva
93/113/CE relativa alla utilizzazione ed alla commercializzazione
degli enzimi, dei microrganismi e di loro preparati
nell’alimentazione degli animali;
r) decreto del Capo del Governo del 20 maggio 1928, recante norme
obbligatorie per l’attuazione della legge 23 marzo 1928, n. 858,
contenente disposizioni per la lotta contro le mosche;
s) decreto del Ministro della sanita’ del 19 giugno 2000, n. 303,
recante regolamento di attuazione della direttiva 96/93/CE relativa
alla certificazione di animali e di prodotti di origine animale;
t) articoli 5, 6, 7, 9 e 10, comma 5, decreto legislativo del 17
giugno 2003, n. 223, recante attuazione delle direttive 2000/77/CE e
2001/46/CE relative all’organizzazione dei controlli ufficiali nel
settore dell’alimentazione animale;
u) decreto del Ministro per l’industria, il commercio e
l’artigianato 3 febbraio 1977, recante regolamento di esecuzione
relativo alle varie fasi di conservazione e di commercializzazione
delle carni congelate, emanato ai sensi dell’art. 2 del decreto-legge
17 gennaio 1977, n. 3;
v) regio decreto 9 maggio 1929, n. 994, recante approvazione del
regolamento sulla vigilanza igienica del latte destinato al consumo
diretto.
Art. 19
Clausola di invarianza finanziaria
1. Dal presente decreto non devono derivare nuovi o maggiori oneri,
ne’ minori entrate a carico della finanza pubblica. Le
amministrazioni interessate svolgono le attivita’ previste dal
presente decreto con le risorse umane, finanziarie e strumentali
disponibili a legislazione vigente.
2. Le spese relative alle registrazioni e ai riconoscimenti degli
stabilimenti previsti dai regolamenti di cui all’articolo 2 sono a
carico delle imprese.
Art. 20
Aggiornamenti tecnici relativi alle attivita’
di campionamento
1. Le modalita’ di campionamento per le analisi, prove e diagnosi
di laboratorio per gli aspetti relativi alle matrici afferenti agli
ambiti di cui all’art. 2, comma 1, sono stabilite nell’allegato 1 al
presente decreto, fermo comunque restando quanto previsto da norme
europee.
2. Le modalita’ di campionamento dei prodotti alimentari, ivi
compresi quelli di origine vegetale e di origine animale, per la
determinazione dei residui di prodotti fitosanitari, ai fini del
controllo della loro conformita’ ai limiti massimi di residui (LMR),
sono stabilite nell’allegato 2 al presente decreto, fermo comunque
restando quanto previsto da norme europee.
3. Le modalita’ di campionamento dei prodotti alimentari, ivi
compresi quelli di origine vegetale e di origine animale, per la
verifica delle caratteristiche qualitative e merceologiche nei
settori di cui all’articolo 2, comma 3, sono stabilite nell’allegato
3 al presente decreto, fermo comunque restando quanto previsto da
norme europee e da norme nazionali di settore.
4. Con decreto del Ministro della salute, previa intesa in sede di
Conferenza permanente per i rapporti tra lo Stato, le regioni e le
Province autonome di Trento e Bolzano, ai sensi dell’articolo 3 del
decreto legislativo 28 agosto 1997, n. 281, sono aggiornate le
modalita’ tecniche relative alle attivita’ di campionamento in
riferimento alle normative europee specifiche, previste dagli
allegati 1 e 2 al presente decreto.
5. Con decreto del Ministro delle politiche agricole alimentari e
forestali, previa intesa in sede di Conferenza permanente per i
rapporti tra lo Stato, le regioni e le Province autonome di Trento e
Bolzano, sono aggiornate, nei settori di cui all’articolo 2, comma 3,
del presente decreto, le modalita’ tecniche relative alle attivita’
di campionamento previste dall’allegato 3 al presente decreto.
Il presente decreto, munito del sigillo dello Stato, sara’ inserito
nella Raccolta ufficiale degli atti normativi della Repubblica
italiana. E’ fatto obbligo a chiunque spetti di osservarlo e di farlo
osservare.
Dato a Roma, addi’ 2 febbraio 2021
MATTARELLA
Conte, Presidente del Consiglio dei
ministri e, ad interim, Ministro
delle politiche agricole alimentari e
forestali
Amendola, Ministro per gli affari
europei
Speranza, Ministro della salute
Di Maio, Ministro degli affari esteri
e della cooperazione internazionale
Bonafede, Ministro della giustizia
Gualtieri, Ministro dell’economia e
delle finanze
Boccia, Ministro per gli affari
regionali e le autonomie
Patuanelli, Ministro dello sviluppo
Visto, il Guardasigilli: Bonafede
Parte di provvedimento in formato grafico
Parte di provvedimento in formato grafico
Parte di provvedimento in formato grafico
Allegato 1
Allegato 2
Allegato 3
economico
Guerini, Ministro della difesa
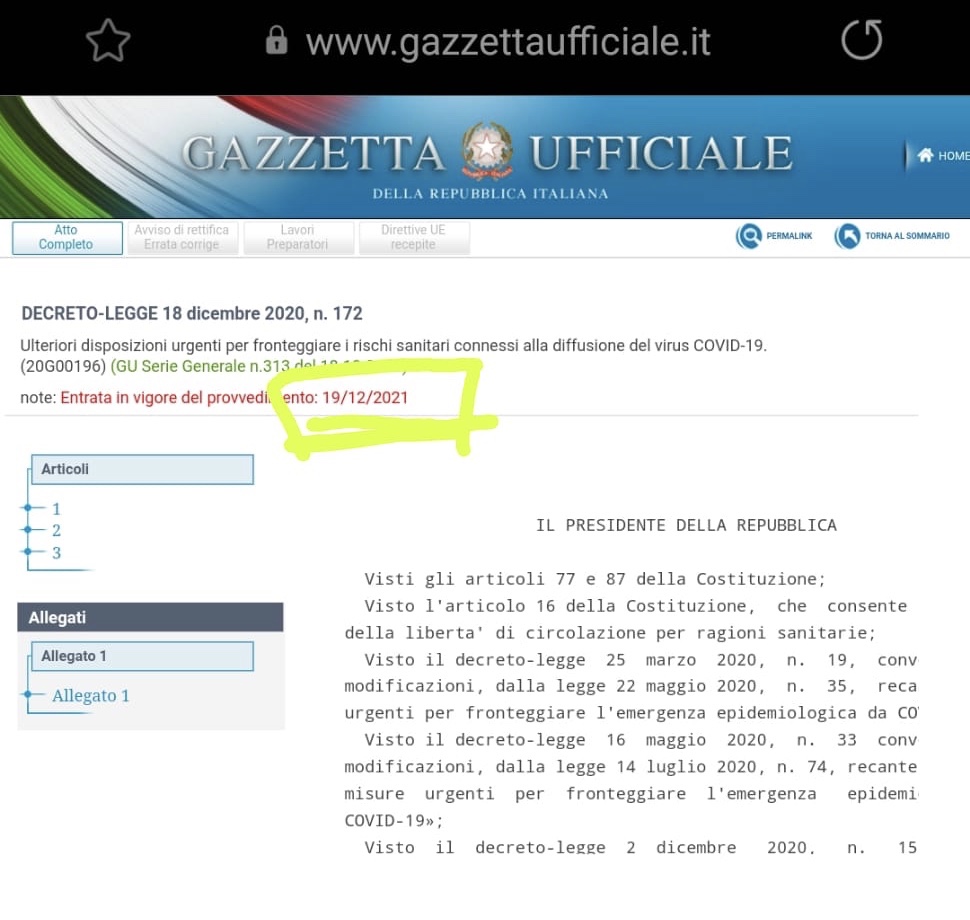 Il Lockdown di Natale? Entra in vigore il 21 dicembre ma sul decreto pubblicato in Gazzetta Ufficiale c’è scritto il 19 dicembre 2021.
Il Lockdown di Natale? Entra in vigore il 21 dicembre ma sul decreto pubblicato in Gazzetta Ufficiale c’è scritto il 19 dicembre 2021. Dopo l’aiuto all’ammasso va via anche il fondo emergenza alimentare. O meglio: l’Italia dovrà comprare anche prodotti europei.
Dopo l’aiuto all’ammasso va via anche il fondo emergenza alimentare. O meglio: l’Italia dovrà comprare anche prodotti europei. Si legge: 1.A valere sulle disponibilità del Fondo di Rotazione di cui alla legge 16 aprile 1987, n.183, è destinato l’importo di 250 milioni di euro ad integrazione delle iniziaitive di distribuzione delle derrate alimentari per l’emergenza derivante dalla diffusione del virus COVID-19, cui concorre il Fondo di aiuti europei agli indigenti FEAD 2014-2020 istituito dal regolamento UE n.223/2014 del Parlamento europeo e del Consiglio dell’11 marzo 2014.
Si legge: 1.A valere sulle disponibilità del Fondo di Rotazione di cui alla legge 16 aprile 1987, n.183, è destinato l’importo di 250 milioni di euro ad integrazione delle iniziaitive di distribuzione delle derrate alimentari per l’emergenza derivante dalla diffusione del virus COVID-19, cui concorre il Fondo di aiuti europei agli indigenti FEAD 2014-2020 istituito dal regolamento UE n.223/2014 del Parlamento europeo e del Consiglio dell’11 marzo 2014. Qui di seguito invece l’articolo come era stato concepito dal Mipaaf e approvato dal Consiglio dei ministri.
Qui di seguito invece l’articolo come era stato concepito dal Mipaaf e approvato dal Consiglio dei ministri.

